成功の本質第81回 オプジーボ/小野薬品工業
日本発の新しい免疫薬ががん治療を一変させる
 2014年9月に販売開始のがん治療薬オプジーボ。薬価は20mg(左)が15万200円、100mg(右)が72万9849円だ。
2014年9月に販売開始のがん治療薬オプジーボ。薬価は20mg(左)が15万200円、100mg(右)が72万9849円だ。
Photo=小野薬品工業提供
がんは日本人の死亡原因の第1位の疾患であり、年間死亡者の3人に1人はがん患者が占める。外科療法、抗がん剤の化学療法、放射線療法が3大治療法とされるが、ここにきて第4の治療法と呼ばれる免疫療法で、まったく新しい薬剤が登場。「がん治療が一変する可能性がある」と注目を集めている。
大阪の製薬会社、小野薬品工業が2014年9月、皮膚がんの一種、根治切除不能な悪性黒色腫(メラノーマ)を対象に、世界に先駆けて発売した抗PD-1抗体医薬「オプジーボ(一般名ニボルマブ)」だ。
免疫は人体に侵入したウイルスなどの外敵をリンパ球が異物と認識し、排除する防御機構。抗PD-1抗体は、リンパ球の一種で免疫機能を司るT細胞の表面に発現するPD-1という分子の働きに注目した。その試験結果が世界最高権威の臨床医学雑誌"The New England Journal of Medicine"で報告されたのは2012年のことだ。
治療法のないメラノーマや腎細胞がんの症例で、30%近い奏効率(がんが消失または一定以上収縮した割合)に世界中の臨床医が驚いた。今では毎号、抗PD-1抗体の治療成績が報告され、米国臨床腫瘍学会の総会でもがん免疫療法の講演は聴講希望者が会場に入りきらないほどの盛況ぶりだ。この抗PD-1抗体をいち早く製品化したのが、オプジーボだった。
「10年後にはほとんどの抗がん剤は使われなくなり、抗PD-1抗体医薬が第1選択肢になるでしょう」
こう話すのは、1992年にPD-1を発見し、その機能やがん治療のメカニズムを解明した分子免疫学の第一人者、本庶佑(ほんじょ たすく)・京都大学大学院客員教授だ。長年、ノーベル医学生理学賞の有力候補者にあげられ、73歳の今も研究と後進の指導で多忙な日々を送る。
「PD-1の発見は偶然でした。免疫学の最大の課題は、なぜ免疫が"自己=自分の体"と"非自己=他者"を認識し、自分の体は攻撃せずに、他者を攻撃するのかを解明することです。がん細胞も遺伝子変異を繰り返すので、自己にとって他者です。PD-1は免疫の根本の仕組みを解明するなかで偶然、発見されたのです」(本庶)
「免疫のブレーキ」を外す
 本庶佑氏
本庶佑氏
京都大学大学院医学研究科 客員教授
Photo=勝尾 仁
当時、本庶研究室はあるテーマを追っていた。免疫反応では異物を「抗原」、抗原に対して特異的に反応するものを「抗体」と呼ぶ。免疫の要となるT細胞は骨髄でつくられ、胸部内の胸腺に入り、自己と非自己を見分けられるかどうかで分化する。つまり、胸腺での"訓練"で抗原を認識できて選別されたT細胞は病原体感染細胞の直接破壊など、免疫機構内でさまざまな役割に就くが、うまく認識できないT細胞は自己を排除してしまう恐れがあるため、「細胞死」するようプログラム化されている。割合として90%以上が死滅する。この細胞死を起こす分子を探しているとき、たまたま細胞表面の膜で見つかったのがPD-1の分子だった。
「それは探していた分子ではありませんでした。ただ、構造から見て、細胞の外から中へシグナルを伝えていることが推測できたので、体のなかで何かをしているに違いないと興味を持ちました。そのシグナルがどんなものか、機能はわかりませんでした」(本庶)
見つかった分子はPD-1(Programmed cell Death-1)と命名された。本庶チームは機能を探るため、PD-1の遺伝子を破壊した欠損マウスを使った実験を開始した。すると、半年が過ぎたころ、免疫が過剰に働き、自分の体を攻撃する自己免疫疾患を発症する個体が出てきた。
「そのことから、PD-1は"免疫のブレーキ役"を果たしていることがわかりました。PD-1がなくてもマウスはすぐには発症しなかったので、重篤な副作用はなさそうでした。そこで、ブレーキの原理を1999年に発表し、集中的に取り組んだのが、がん治療への応用でした」(本庶)
普通のマウスと欠損マウスにがん細胞を移植すると、普通のマウスはがん細胞が増殖するのに対し、PD-1がなく、免疫のブレーキが外れて免疫活性が高まった欠損マウスのほうは増えず、明確な差が表れた。
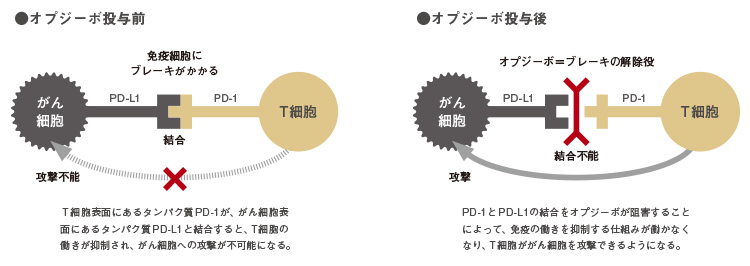
「今度はヒトで応用したいと思いました。免疫にブレーキをかけるシグナルは、T細胞の表面に発現するPD-1が、がん細胞のほうの表面に発現するPD-L1という分子に結合すると発せられます。そこでこの結合をブロックするため、PD-1のほうに特異的に反応する抗体を使おうと考えました。実験でマウス用の抗体をつくって投与すると、がんの増殖が十分に抑えられました。ここに、抗PD-1抗体によるがん免疫療法の原理が開発されたのです。発見から10年後の2002年のことでした」(本庶)
本庶は特許を出願しようとしたが、当時、京大はノウハウも態勢も未整備だったため、共同出願者として声をかけたのが別テーマで共同開発を行っていた小野薬品だった。ここから治療薬の開発へと進む。
異端視されたがん免疫療法
ただ、小野薬品はがん治療薬の開発経験がなく、ヒト型抗体をつくる技術も持っていなかった。そこで、小野薬品は共同開発相手を求め、内外の製薬会社などを1年かけて13社回り、そのすべてに断られた。それは、「従来のがん免疫療法が医学界において異端の扱いを受け、信頼されていなかった」(本庶)ことを如実に物語った。
「そんなことをやっていたら会社を潰しますよと、辛辣な言葉も言われたようです。社内でも評価は高くなく、経営層から厳しいことも言われていました。うちが抗がん剤を集中的にやっている会社だったら開発が止まっていたかもしれません」
小野薬品の粟田浩・副社長兼開発本部長は、当時の状況をこう語る。なぜ、異端扱いだったのか。がん免疫療法が歩んだ道筋を簡単になぞっておこう。
1950年代、後にノーベル賞を受賞するオーストラリアの免疫学者マクファーレン・バーネットが「がん免疫監視説」を唱えたことに始まる。「ヒトの体内では毎日3000個ものがん細胞が生じているが、免疫系がこれを排除し、がんの発症を未然に防いでいる」。しかし、この仮説は誰も実証できなかった。その間、丸山ワクチンなどのがんワクチン、免疫細胞を体外で培養・活性化し、再び体に戻す養子免疫療法など多くの方法が開発された。
「そのすべてが"失敗"とされた。なぜ、失敗したのか。従来のがん免疫療法は免疫力を強化する方法、クルマで例えれば、免疫のアクセルを踏む方法を考えようとしたからです。しかし、がんを発症すると、PD-1とPD-L1の結合によって免疫にブレーキがかかるため、アクセルを踏んでも進まない。免疫寛容と呼ばれる状態で、これを破らないかぎり、免疫の再活性はあり得ない。このブレーキを壊すのが抗PD-1抗体で、まったく発想が違ったのです」(本庶)
しかし、ヒト型抗体の共同開発相手は見つからず、小野薬品はいったん断念。本庶は独自に探したが、特許出願から1年後に内容が公開され、それを見た米国のベンチャー、メダレックス社(当時。その後ブリストル・マイヤーズスクイブが買収)から小野薬品にアプローチがあり、2005年、共同開発が始まった。同年末、抗PD-1抗体が完成。翌2006年、米国食品医薬品局(FDA)の認可を得て、米国で臨床試験が開始された。
人体への効果が不明な治療薬の場合、ほかに治療法の選択肢がなくなった患者が対象となる。治療を行った約300例では、安全性を確認するフェーズⅠ(第1相試験)の段階で効果が顕著に表れ、その結果が冒頭の臨床医学雑誌で報告されて、全世界の注目を浴びた。
日本でも2008年から小野薬品が臨床試験を開始する。
「従来の免疫療法を評価してこなかったがん専門医を説得して、試験をしてもらいました。最初は優先順位がいちばん下でしたが、メラノーマに対し明確に効く症例が出ると、順位がいちばん上にあがっていったのです」(粟田)
世界に先駆け日本でスピード承認
 粟田浩氏
粟田浩氏
小野薬品工業 取締役兼副社長執行役員 開発本部長
Photo=勝尾 仁
京大でも治療法がなくなった卵巣がん患者を対象に試験を行った。結果、20例中2例でがんが完全消失し、1例で縮小が認められた。
「完全消失した方が先日、テレビで取材を受け、ゴルフ姿が映されたのには驚きました。もう1つ、興味深い例がブラインドテストの結果です」(本庶)
メラノーマ患者を2群に分け、一方には抗PD-1抗体を、もう一方には抗がん剤を投与し、患者にも、医師にもそれを伏せる。1年半後の生存率は前者が7割、後者が2割足らずで、歴然とした差にそれ以上の継続は中止になった。
治験を経て、小野薬品のオプジーボが2014年7月、世界に先駆けて日本で承認された。申請から約半年の超スピード承認だ。現在、肺がんや腎臓がんへの適応をそれぞれ、申請中、申請準備中だ。1回の投与で薬価が約73万円と高いが、市場が拡大すれば、薬価の再算定も予想される。
抗PD-1抗体医薬の効能は、次のように説明される。まず、ほとんどすべてのがんに効く。ただ、効き方はがんによって異なる。一度がんが消失したら再発はほとんどない。副作用は、抗がん剤のような脱毛、嘔吐、下痢といった症状はないが、ゼロではなく、自己免疫疾患による関節炎、腸炎、肺炎などには注意が必要だ。ただ、効く人と効かない人がおり、その理由は何か、事前に判別できないかを解明することが、「今の最大の課題」だという。
がん治療に転換をもたらすことになったPD-1の発見。なぜ、それは可能だったのか。本庶は語る。
「ライフサイエンスでは、昔は全体しかわからなかったのが、分子がわかるようになりました。そのことで、最近は分子に入り込み、全体を見失うケースが増えています。私はその分子が全体のなかでどんな働きをしているかを常に考えてきました。私は医学部出身の医者でもあり、若い頃、友人を胃がんでなくしたこともあって人の病気を治したいという思いも強くありました」
期待される産学Win-Win連携
分子の向こうに全体をとらえる視点と強い問題意識が、偶然の発見を必然化したのかもしれない。
「ただ、同時にライフサイエンスは博打で、どの馬が1着になるか、やってみないとわからない。私は運がよかったのですが、基礎研究に投資し、100に1つでも面白いものができればいいという、数を打つ考え方でないと発見はできません。必要なのは資金です。大学発のシーズを企業が製品化して成功したら、大学へ利益を還元し、次のシーズを生みだしていく。そんなWin-Win関係を構築する意識を日本の製薬会社に持ってほしいのです」(本庶)
がん免疫薬には今、メガ・ファーマと呼ばれる世界的巨大製薬会社が続々参入。一方、日本の製薬会社は世界ランキングのトップ10に1社も入っていない。オプジーボは大学発の創薬の成功例といえるが、日本企業の国際競争力を高めるためにも、Win-Win関係の先例になることが期待される。(文中敬称略)
Text=勝見明
異質な関係性から生まれたイノベーション
駆動役は「跳ぶ帰納法」とメタファー
- 野中郁次郎氏
- 一橋大学名誉教授
- 抗PD-1抗体医薬の原理開発はT細胞表面でのPD-1の「偶然の発見」から始まった。それを本庶氏の研究室はがん治療におけるイノベーションに結びつけた。企業の研究開発も偶然の発見から始まり、イノベーションに至るケースが少なくない。
本庶氏は「運がよかった」と言うが、誰もが運を引き寄せ、偶然を必然化できるわけではない。オプジーボの事例から学ぶべきは、イノベーションを生む創造の方法論であり、わけても大切なのは、前号でも述べた「跳ぶ帰納法」である。
イノベーションは、既存の命題から論理的に正解を導き出す演繹法からは生まれない。本庶氏が実験を重視するように、個別具体の現実のなかで関係性を抽出する帰納法が必要だが、単なる帰納法では同質的な関係性のなかにとどまりがちだ。そこで異質な関係性へとジャンプする跳ぶ帰納法の出番となる。
当初、胸腺でT細胞の大半が死滅する仕組みの原因分子を探し、発見したのは、想定していたのとは違う分子だった。そこから「免疫のブレーキ役」という、これまでにない異質な関係性の概念を導き出したのは跳ぶ帰納法によるものだ。
それにはどんな発想が必要だったか。まず注目すべきは、本庶氏が同級生を胃がんでなくしていることだ。そこからヒューマニズム的な「病いを治す」という目的意識を持ち続けた。結果、分子という部分を分析的に見るだけでなく、全体のなかでの働きを総合的に見る視点を忘れなかった。
また、免疫系を外敵との戦いに、そのメカニズムをアクセルとブレーキに例えるなど、メタファーを巧みに操る点もきわめて印象的だ。
既存の関係性を超えて跳ぶには、明確な目的のもとで、部分を全体のなかで認識し、その全体を部分として、より大きな関係性を求めて新たな全体を描く「ダイナミックな往還運動」と、その運動を媒介するメタファーが重要な役割を担っている。
もう1つ、本庶氏の跳ぶ帰納法を下支えしたものとして、仮説を立てては実験を行う数多くの繰り返しのなかで「パターン認識の引き出し」が蓄積されていたことも見逃せない。
アカデミアの世界でそれを推進するには、大学と産業界の資金面での連携が不可欠だ。大学発創薬の成功例であるオプジーボの開発が、その面でも産学連携のモデルケースになることを望みたい。
-
 野中郁次郎氏
野中郁次郎氏 - 一橋大学名誉教授
- Nonaka Ikujiro 1935年生まれ。早稲田大学政治経済学部卒業。カリフォルニア大学経営大学院博士課程修了。知識創造理論の提唱者でありナレッジマネジメントの世界的権威。2008年米経済紙による「最も影響力のあるビジネス思想家トップ20」にアジアから唯一選出された。『失敗の本質』『知識創造企業』など著書多数。
